Verzending 24–48 u • Levering in de hele EU • Veilige chemieverpakking
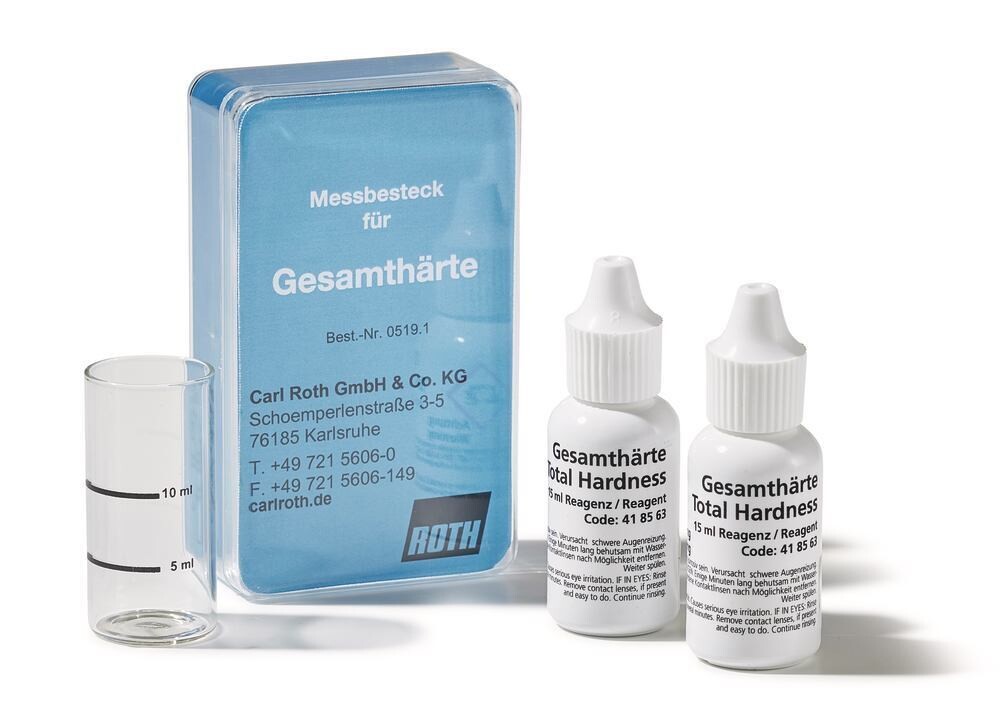
Kit de mesure de la dureté de l'eau
Référence 0519.1
€ 36,49
En stock
1
Enregistrer ce produit pour plus tard
Kit de mesure de la dureté de l'eau
Détails du produit
Code SH: 90278990
EAN: 8721028019479
Marque: Tintometer GmbH
À un échantillon d’eau de 5 ml, on ajoute goutte à goutte du réactif jusqu’au virage de la couleur. À chaque goutte correspond 1 °dH.
Kits de mesure dureté de l’eau
Livraison incl. tube pour échantillon.
Informations techniques
| Mise en évidence de | Dureté de l'eau |
| Cdt. | 2 x 15 ml |
| Emb. | 2 x 15 ml |
Détermination de la dureté de l’eau
Outre des gaz dissous (oxygène, azote, dioxyde de carbone), l’eau contient toute une série de sels et autres composés. Les principaux composants sont le magnésium, le calcium, sous forme de chlorures, sulfates et carbonates d’hydrogène. Ces sels dissous sont appelés des agents de dureté. À la chaleur (cuisson), les carbonates d’hydrogène se précipitent en carbonates ; c’est ce que l’on appelle la dureté carbonatée ou dureté temporaire. La dureté permanente ou dureté non carbonatée caractérise les composés de sulfate et de chlorure. On entend par dureté totale la concentration de l’eau en ions de métal alcalino-terreux.
L’unité de mesure de la dureté de l’eau était autrefois le °dH (degré de dureté allemand) et correspondait à 10,00 mg CaO ou 7,19 mg MgO par litre. Aujourd’hui, l’unité millimol/litre (mmol/l) est la seule autorisée. 1 °dH correspond à 0,18 mmol/l d’ions de métal alcalino-terreux et 1 mmol/l correspond à 5,6 °dH.
Vous aimerez peut-être aussi

2-Chloro-6-(trifluoromethyl)benzonitrile, 95.0%, 5g
2-Chloro-6-(trifluoromethyl)benzonitrile, 95.0%, 5g
Référence F319626-5G
€ 99,00

2,4-dichloro-1-ethenylbenZene, 95% mix TBC as stabilizer, 1g
2,4-dichloro-1-ethenylbenZene, 95% mix TBC as stabilizer, 1g
Référence F647538-1G
€ 1 482,80
![5-CHLOROBENZO[C][1,2]OXABOROL-1(3H)-OL, 95%, 500mg 5-CHLOROBENZO[C][1,2]OXABOROL-1(3H)-OL, 95%, 500mg](https://d2j6dbq0eux0bg.cloudfront.net/images/88473019/4863756278.png)
5-CHLOROBENZO[C][1,2]OXABOROL-1(3H)-OL, 95%, 500mg
5-CHLOROBENZO[C][1,2]OXABOROL-1(3H)-OL, 95%, 500mg
Référence F829860-500MG
€ 1 376,10

21-Chloro-3,6,9,12,15-pentaoxahenicosan-1-ol, 95%, 250mg
21-Chloro-3,6,9,12,15-pentaoxahenicosan-1-ol, 95%, 250mg
Référence F602398-250MG
€ 316,80

3-Amino-2-methyl-propionic acid hydrate, 97.0%, 5g
3-Amino-2-methyl-propionic acid hydrate, 97.0%, 5g
Référence F040039-5G
€ 206,80

5-Chloro-6-methoxypyridin-3-amine, 95.0%, 10g
5-Chloro-6-methoxypyridin-3-amine, 95.0%, 10g
Référence F321041-10G
€ 59,40
![2-[(phenylamino)methyl]aniline, 95%, 250mg 2-[(phenylamino)methyl]aniline, 95%, 250mg](https://d2j6dbq0eux0bg.cloudfront.net/images/88473019/4857604869.png)
2-[(phenylamino)methyl]aniline, 95%, 250mg
2-[(phenylamino)methyl]aniline, 95%, 250mg
Référence F675763-250MG
€ 163,90

2,5-Difluoro-4-hydroxybenzaldehyde, 99.0%, 5g
2,5-Difluoro-4-hydroxybenzaldehyde, 99.0%, 5g
Référence F045012-5G
€ 699,60

Methyl (3-chlorophenyl)carbamate, 2.5g
Methyl (3-chlorophenyl)carbamate, 2.5g
Référence F982825-2.5G
€ 1 927,20
Afficher les prix en :EUR

![(1R)-1'-methyl-8-azaspiro[bicyclo[3.2.1]octane-3,4'-imidazolidine]-2',5'-dione hydrochloride, 97%, 250mg (1R)-1'-methyl-8-azaspiro[bicyclo[3.2.1]octane-3,4'-imidazolidine]-2',5'-dione hydrochloride, 97%, 250mg](https://d2j6dbq0eux0bg.cloudfront.net/images/88473019/4762854027.png)
![METHYL 4-CHLOROTHIENO[3,2-D]PYRIMIDINE-7-CARBOXYLATE, 95.0%, 1g METHYL 4-CHLOROTHIENO[3,2-D]PYRIMIDINE-7-CARBOXYLATE, 95.0%, 1g](https://d2j6dbq0eux0bg.cloudfront.net/images/88473019/4780731060.png)
